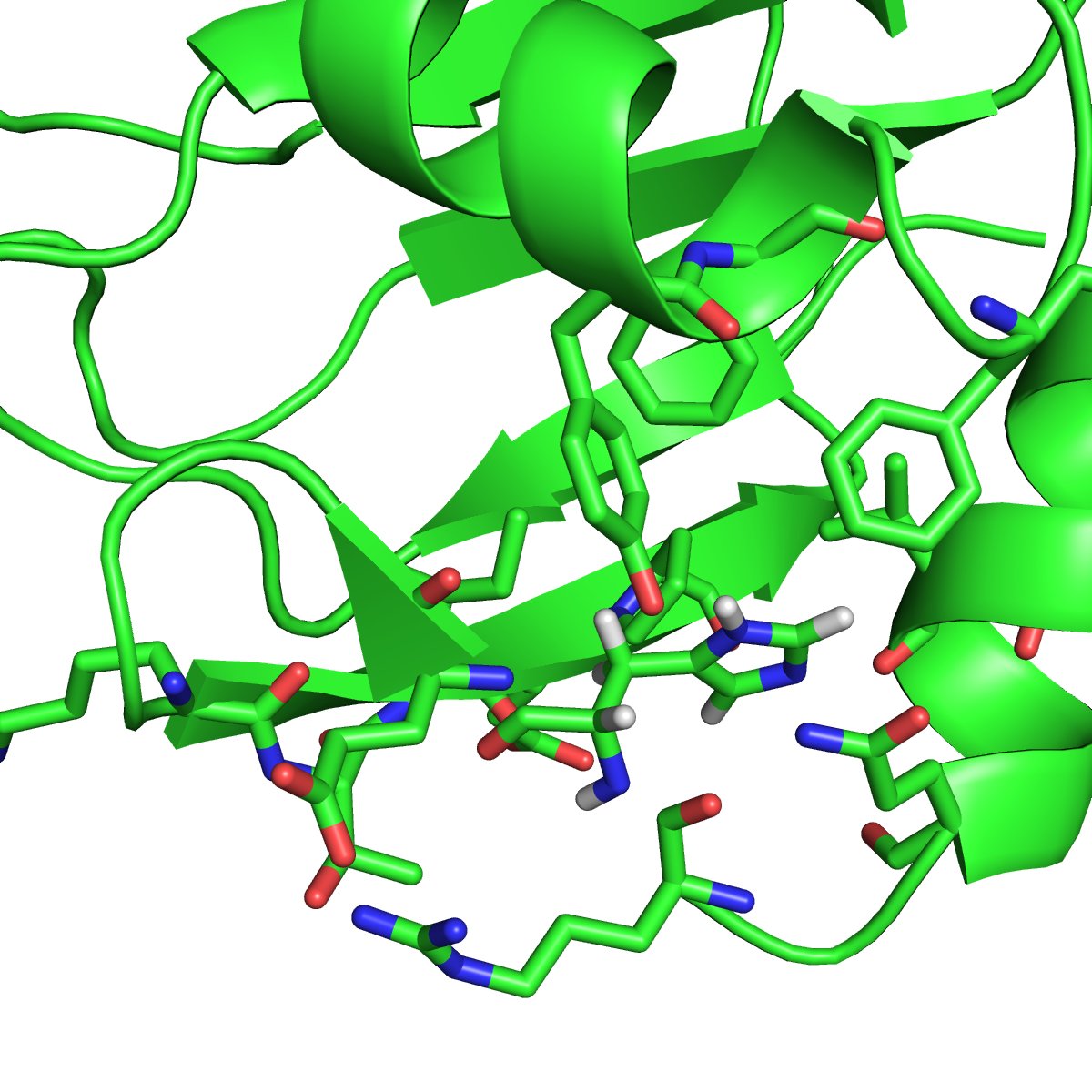
Faktum är att diagrammet ovan inte är fel; det är helt korrekt. Faktum är att histidin kan bära en nettoladdning, men när det är oprotonerat, dvs i ett laddningsneutralt tillstånd, kan dess aromatiska π-system (som tillhör imidazoldelen) bete sig som en hydrofob grupp, t.ex. det kan bli involverat i π-stacking (aka CH-π) interaktioner. I 2RS2 NMR-strukturen är HIS83 till exempel δ-protonerad och verkar fungera som en typisk hydrofob rest: den är begravd under proteinytan, staplad mot flera aromatiska rester och packad tillsammans med flera alifatiska; den är skyddad från lösningsmedel av polära och laddade rester.
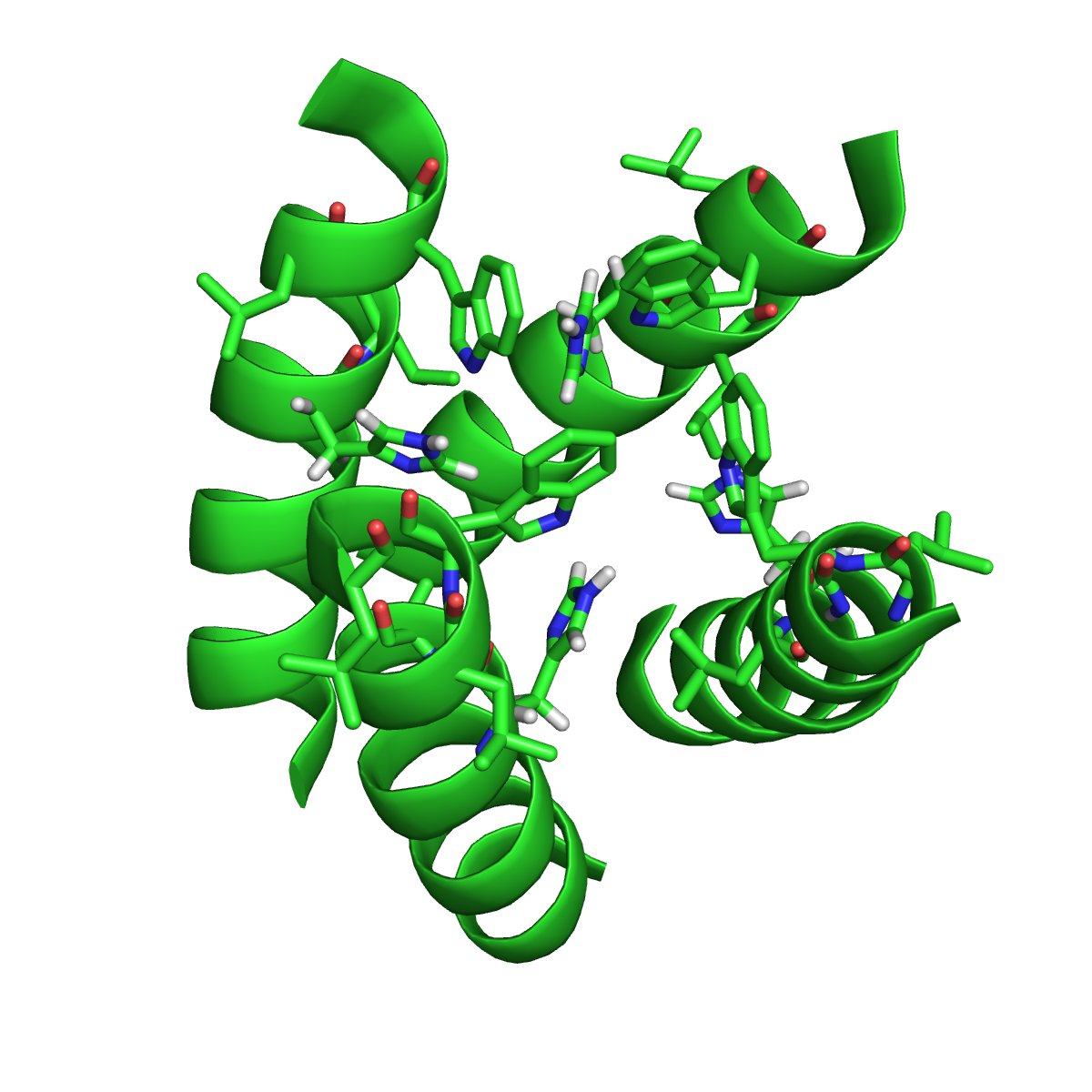
2H95 är en mycket intressant struktur där vi se fyra ε-protonerade histidiner staplar mot tryptofaner, samt packar mot alifatiska sidokedjor, bildar en transmembran protonkanal. Histidinerna verkar vara inblandade i hydrohobiska interaktioner och bildar samtidigt kanalens inre yta.
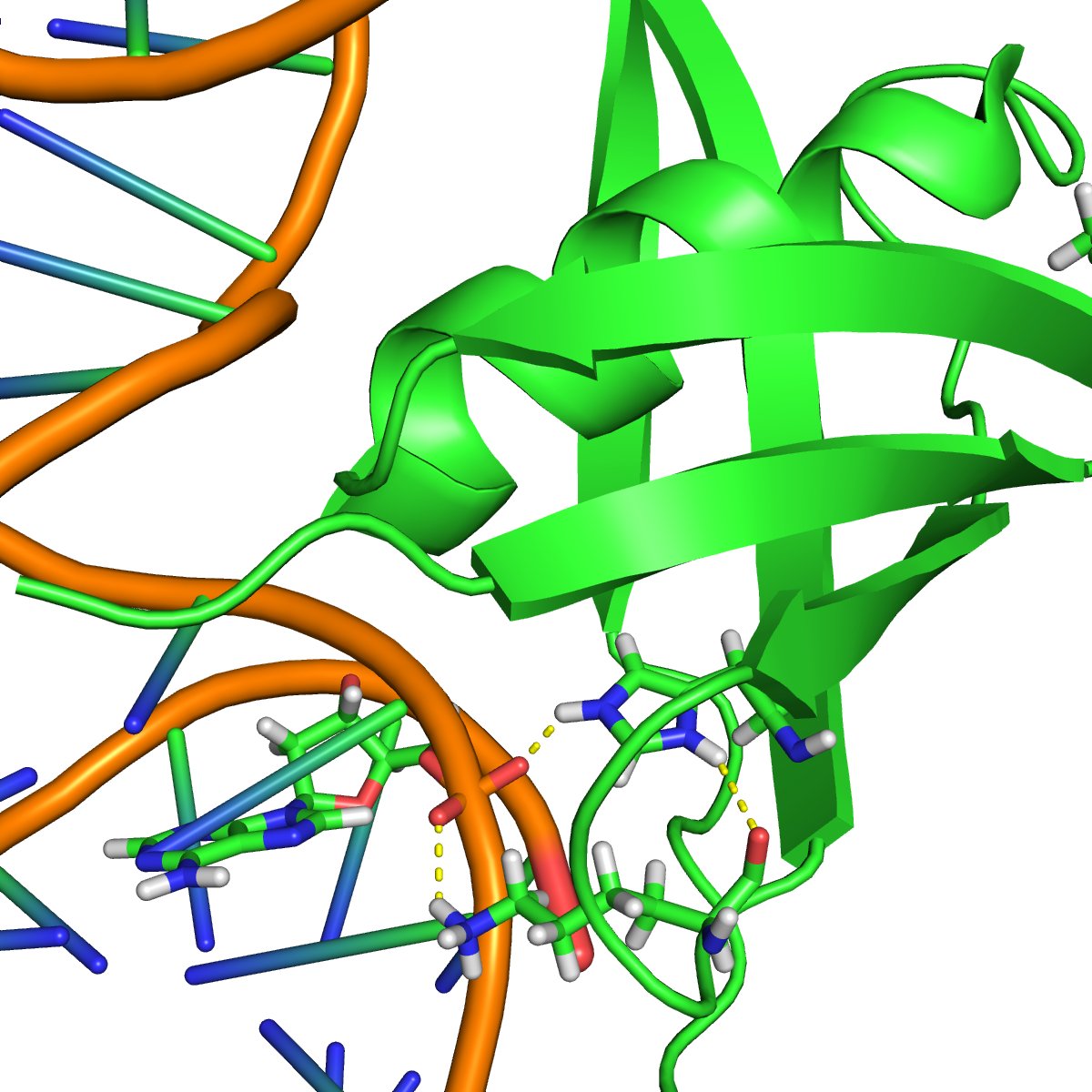
Omvänt, i 2NBJ NMR-strukturen ser vi HIS56 beter sig som en polär aminosyra - dess (dubbelt protonerad) sidokedja är involverad i vätebindning till ryggraden i ett DNA-fragment, såväl som till en ryggradens syreatom från proteinet. Dessutom, i samma struktur är HIS16 dubbelt protonerad och exponerat för lösningsmedel, sannolikt interagerar med vatten och bidrar till solvatisering, i skarp kontrast till HIS83 i 2RS2 strukturen, som är monoprotonated och begravd i det hydrofoba inre av proteinet.
Histidins pKa kan lätt störas av dess omgivning, t.ex. av de omgivande resterna i ett enzymaktivt ställe, vilket gör den mycket funktionellt mångsidig, en av manifestationerna av dess funktionella och kemiska mångsidighet är dess förmåga att bete sig både som en polär / laddad aminosyra, liksom en hydrofob rest; detta är anledningen till att histidin ofta finns i funktionella ställen i proteiner, t.ex. enzymaktiva centra.